コラム&メッセージ
COLUMN&MESSAGE
発表論文 Publications ▸ 研究紹介 Researches ▸ プロトコール Protocol ▸ コラム&メッセージ Column&Message ▸
先進分子腫瘍学分野
教授 合山 進
連絡先 ▸ 03-5449-5782 goyama@ims.u-tokyo.ac.jp
03-5449-5782
goyama@ims.u-tokyo.ac.jp
Message
私が研究を始めた20年前、がん研究は暗闇の中の探求に等しい状況でした。腫瘍発生の分子メカニズムのほとんどが未解明で、治療の選択肢は極めて限定的。網羅的解析という概念が存在せず、Western blottingやqPCRを用いて個々の遺伝子の機能を地道に調べるのが主流でした。
しかし現在、がん研究はパラダイムシフトを迎えています。ゲノム解析技術の飛躍的進歩により主要な遺伝子異常の多くが同定され、CRISPR/Cas9の登場で精密なゲノム編集が当たり前に行えるようになりました。またオミクス解析は当たり前になり、「ビッグデータの解釈力」は今や研究者の必須スキルです。
このような研究技術の進歩にもかかわらず、根治可能ながんは依然としてごく一部に限られます。「がんを感染症のように当たり前に治すことのできる疾患へ」というビジョンを実現するためには、基礎と臨床をつなぐ地道な研究の積み重ねに加え、革新的なブレイクスルーが必要です。
<スピードと主体性を軸に>
がん研究の次のブレークスルーを創るため、当研究室ではスピードと研究者の主体性を重視します。
・スピード
「発見の迅速な公開」を最優先し、研究成果を適切なタイミングで社会に還元します。トップジャーナル至上主義ではなく、研究のインパクトとスピードのバランスを重視します。
・研究者の主体性
最近私発表した論文の多くに、学生の自主的な取り組みから生まれた予想外の発見が含まれています。与えられた課題をこなすだけでなく、自ら主体的に研究に取り組む姿勢が、真に価値ある研究成果を生むと信じています。そこで、個人の創造性を阻害するマイクロマネジメントは意図的に排除し、好奇心が研究意欲へと繋がる環境づくりに注力しています。
「主体的に研究を進めどんどん論文を書きたい」という意欲的な学生を募集しています。共に次世代のがん治療の扉を開きましょう。
Column
私が研究を開始した2000年代には、がん幹細胞研究が大流行していました。トロントのJohn Dick博士のグループが提唱した 「全てのがん細胞の基となる幹細胞が存在する」という“がん幹細胞”のコンセプトは美しく魅力的で、幹細胞を標的とした根治療法開発への期待も高まりました。 その頃私は、大学院生として転写因子EVI1のコンディショナルノックアウトマウス作製に取り組んでいました(下写真)。

EVI1は予後不良の白血病で高発現している転写因子です。分業化の進んだ現在では遺伝子改変マウスの作製は得意な研究室に頼むのが一般的ですが、 当時は自分達で作るのが普通で、私も先輩や実験助手さんの助けを借りて試行錯誤しつつ自作しました。 それだけにマウスが完成し、さらにEVI1欠失マウスで造血幹細胞が著減しているのを見つけた時はうれしかったです。 この結果はEVI1が“白血病幹細胞”の鍵因子であることを示しており、これ以降、がん幹細胞の特性に興味を持つようになりました。 そこで私は2009年にCincinnati Children’s Hospital Medical CenterのJames C. Mulloy博士の元に留学、 PatientderivedXenograft(PDX)モデルを活用した研究を開始しました(下写真)。

ヒトがん細胞を免疫不全マウスに移植するPDXモデルは、がん幹細胞研究の中心となる研究手法です。 ところがこの頃から、次第に「がん幹細胞研究」の様々な問題点が明らかになってきました。 まず、様々な実験系の改良に伴い、“がん幹細胞”としての能力を持つ細胞が、実は意外とたくさんあることが判明しました。 実験系によって結果が変わってしまうことは科学としては大問題で、がん幹細胞研究への信頼が揺らぐきっかけとなりました。 また、次世代シークエンサーの登場によりがんの遺伝子変異が次々と同定されると、結果が不安定ながん幹細胞研究よりもゲノム解析の方に多くの注目が集まるようになりました。 さらに2010年代に入ると、腫瘍免疫研究が大流行するようになりました。 ところが、「免疫不全マウス」への移植実験が中心となるがん幹細胞研究は、当初この流行に乗ることができず、私自身も苦しい時期を過ごしました。 しかし最近、幹細胞学とゲノム学や免疫学の融合が進み、がんのクローン進化や腫瘍免疫との関係を取り込んだ、新しいがん幹細胞学が再び脚光を浴びています(下図)。 例えば私達は最近、白血病幹細胞が腫瘍免疫からの攻撃を免れることにより治療抵抗性を示すことを明らかにしました。 また、エピゲノム制御因子ASXL1が加齢に伴う前白血病幹細胞の増殖を促進していることを見出しました。 さらに、これまで開発が難しかった白血病幹細胞制御に関与する転写因子標的薬の開発も、様々な創薬技術を活用することで実現可能な時代となってきました。 現在私達は、最新のタンパク質工学やRNA干渉技術を用いて、新しい転写因子標的薬の開発を進めています。
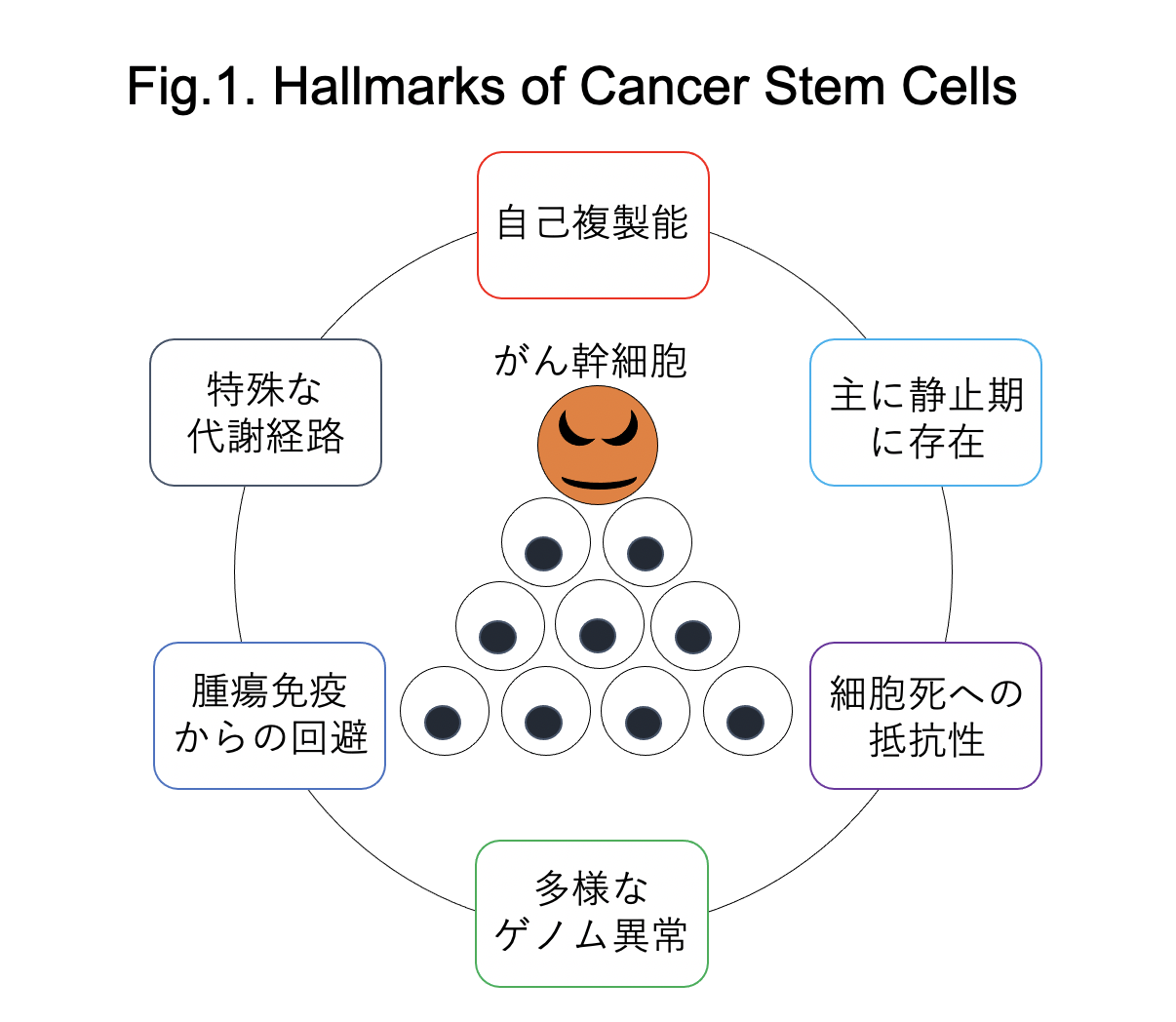
「がんを治す」ためには、がんの発症、再発の根源であるがん幹細胞研究が不可欠です。 がん幹細胞はどこから来るのか、なぜ一部のがん幹細胞の根絶はとても難しいのか、解決すべき謎はまだまだたくさんあります。 これからもゲノム学・免疫学と融合した新しいがん幹細胞学を推進し、がんの根治を目指したいと思います。
(「創成」第37号より一部改変し転載)
